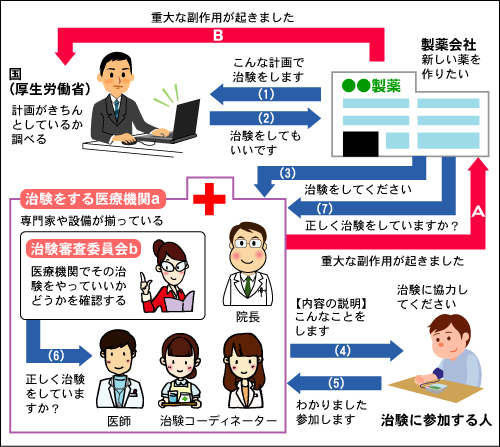
治験実施において、治験に参加する人の人権や安全性、プライバシーを守るために厳しいルールが定められています。
※イラストをクリックすると拡大します。
●治験内容を届出(1)
製薬会社は、治験の内容が記載された「治験実施計画書」を国(厚生労働省)に届け出ます。「治験実施計画書」は製薬会社と専門家が協議して作成されます。
●国(厚生労働省)での調査(2)
届出を受けた「治験実施計画書」の内容に問題がないか(人権と安全性に配慮されているかなど)を調査し、問題があれば修正を指導します。
●製薬会社が医療機関に治験を依頼(3)
●インフォームド・コンセント(4)(5)
治験の目的やこれまでに分かっている「くすりの候補」の効き目、副作用などが記載された同意説明文書をもとに、治験担当医師などが、治験参加を希望する人に説明を行います。文書により同意をした人のみが治験に参加します。
●治験の適正な実施の確認(6)(7)
「治験実施計画書」や治験のルール(GCP)を守って、治験が適正に行われているかを確認します。
治験を行う医療機関のルール
●専門家や設備が揃った医療機関(a)
治験を行う医療機関は、専門の医師をはじめとするCRC(治験コーディネーター)などのスタッフが揃っていて、十分な設備が整っていなければなりません。
●治験審査委員会での確認(b)
医療機関では、治験に参加する人の人権や安全を守って「くすりの候補」の治療効果を科学的に調べることができるかなどを、慎重に治験審査委員会で確認をします。この治験審査委員会とは、医師などの医療関係者だけではなく、医療機関と利害関係がない人と専門外の人も必ず参加します。
重大な副作用の国(厚生労働省)への報告(AB)
治験中に起きた重大な副作用は、医療機関から製薬会社に連絡され、さらに製薬会社から国(厚生労働省)に報告されます。治験に参加している人の安全性を守るため、必要な場合には治験の見直しが行われます。